Begrebet apopleksi
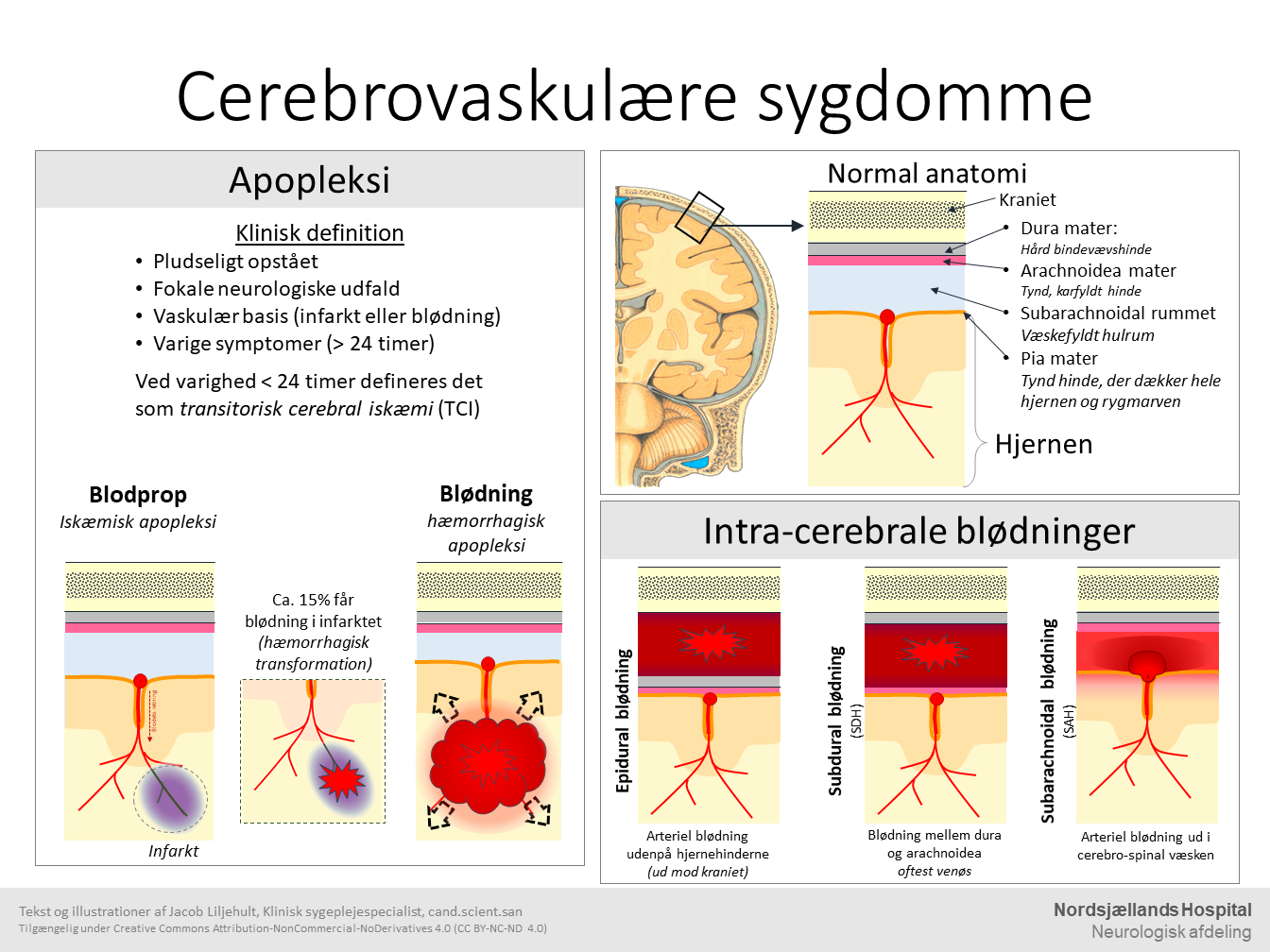
Apopleksi defineres som "pludseligt opståede fokalneurologiske symptomer af formodet vaskulær genese med en varighed på over 24 timer" (Dansk selskab for apopleksi 2013; World Health Organization 1978). Tilfælde af mindre end 24 timers varighed betegnes 'transitorisk cerebral iskæmi' (forkortet TCI). Hos 30-50% af patienter med TCI kan man efterfølgende finde vævsforandringer i hjernen på en MR-skanning. Derfor er en nyere definition blevet foreslået, hvor der både skal være remission af neurologiske udfald og fravær af vævsskade, men denne definition er endnu ikke fuldt udbredt (Easton et al. 2009).
Pludseligt og forbigående synstab på grund af forstyrrelse af blodforsyningen til øjet kaldes 'amaurosis fugax' udredes og behandles oftest på samme måde som TCI.
To typer af apopleksi
Apopleksi kan overordnet deles i to typer: iskæmisk apopleksi og intracerebral hæmorrhagi, hvor iskæmisk apopleksi skyldes iskæmi (iltmangel) i vævet og hæmorrhagi skyldes en blødning ud i vævet.
Iskæmisk apopleksiEn iskæmisk apopleksi er forårsaget af en pludselig blokering af en arterie i hjernen, som forårsaget hypoperfusion af hjernevævet i et afgrænset område, der svare til det område arterie forsyner med blod. Nervecellerne har behov for en konstant tilførsel af ilt og glukose for at danne den energi, som holder cellens funktioner i gang. Når ikke der kommer tilstrækkeligt med blod ud i vævet, bliver tilførslen af ilt og sukker også for lav til at dække cellens behov. Hvis perfusionen kommer under 20% af det normale tryk bliver manglen på ilt så kritisk at cellerne dør indenfor få minutter – det område hvor cellerne dør kaldes for et infarkt. I vævet omkring infarktet vil cellernes metabolisme være tilstrækkelig til at holde cellerne i live, så længe perfusionen holdes mellem 20-50% af normalt tryk – dog vil cellernes funktion være påvirket. Dette område kaldes for penumbra. Men på grund af de forandringer der sker i infarktet, vil perfusionen i penumbra med tiden bliver forværret og, med mindre at blodtilførslen genoprettes indenfor få timer, vil infarktet udvide sig ud i penumbra-zonen (Hossmann & Traystman 2009).
Tilstopningen af arterien kan blive forårsaget af enten en blodprop dannet i den aktuelle arterie (en trombus) eller af en blodprop, som stammer fra et andet sted i arteriesystemet (en trombo-emboli). En trombe dannes på grund af en skade af arteriens inderste lag (intima), hvilket aktiverer det hæmostatiske system (box x) så der dannes en blodprop. Den hyppigste årsag til trombosis er arterosklerose.
Trombo-embolier i hjernen kan stamme fra alle dele arteriesystemet - fra venstre forkammer i hjertet til stedet hvor blokaden sker. Men de fleste embolier i hjernen dannes i hjertet i forbindelse med hjerte-arytmier (fx atrieflimmer), som forstyrre flowet af blod igennem hjertet (Greer et al 2016).
Det hæmostatiske system
Det hæmostatiske system er normalt en fysiologisk funktion, der har til formål at standse blødninger
ved opstår ved både indre og ydre påvirkninger. Men systemet kan også blive aktiveret på en mindre
hensigtsmæssig måde i forbindelse med patologiske processer – hvilket kan føre til at der dannes en
blodprop. Men de underliggende mekanismer er de samme.
Processen består helt overordnet af fire
mekanismer:
1) Reaktion fra karvæggen: Den glatte muskulatur i karvæggen trækker sig sammen, hvilket mekanisk
vil kunne lukke eventuelle huller på karret.
2) Dannelse af en pladeprop: Blodpladerne (trombocytterne) i blodet aktiveres – hvilket
får dem til at ændre form og overfladestruktur – så kan binde sig fast til både karvæggen (adhærens) og
til hinanden (aggregering) og danner en pladeprop på det sted hvor de er blevet aktiveret.
3) Dannelse af fibrin (Koagulation): Pladeproppen er ikke stabil nok til at holde i længden, så
for at stabilisere pladeproppen bliver der dannet et netværk af fibre der består af et klistret protein
der hedder fibrin. Processen der fører til at der dannes fibrin kaldes også for koagulation og består af
en kompleks kaskade af proteiner aktiverer det næste i processen. Alle grundbestanddelene til at lave fibrin
findes allerede i blodet – men i en inaktiv form – og kaldes for koagulationsfaktorer. Koagulationsprocessen
kan blive aktiveret igennem flere forskellige mekanismer, men uanset hvordan den startes er den sidste del
af processen den samme og slutresultatet er derfor også det samme, nemlig dannelsen af fibrin.
4) Afgrænsning af blodproppen (Fibrinolyse): Hvis koagulationsprocessen fik lov til at fortsætte,
ville kroppen på et tidspunkt løbe tør for koagulationsfaktorer og derved blive ude af stand til at standse
nye blødninger. Derfor har koagulationsprocessen en indbygget feedback mekanisme, hvor den i første omgang
kan ’slukke’ for sig selv, når der ikke er behov for at danne mere fibrin – og derved afgrænse processen til
det nødvendige – og dernæst være med til at nedbryde fibrinen sideløbende med at den oprindelige skade på
karret heles.
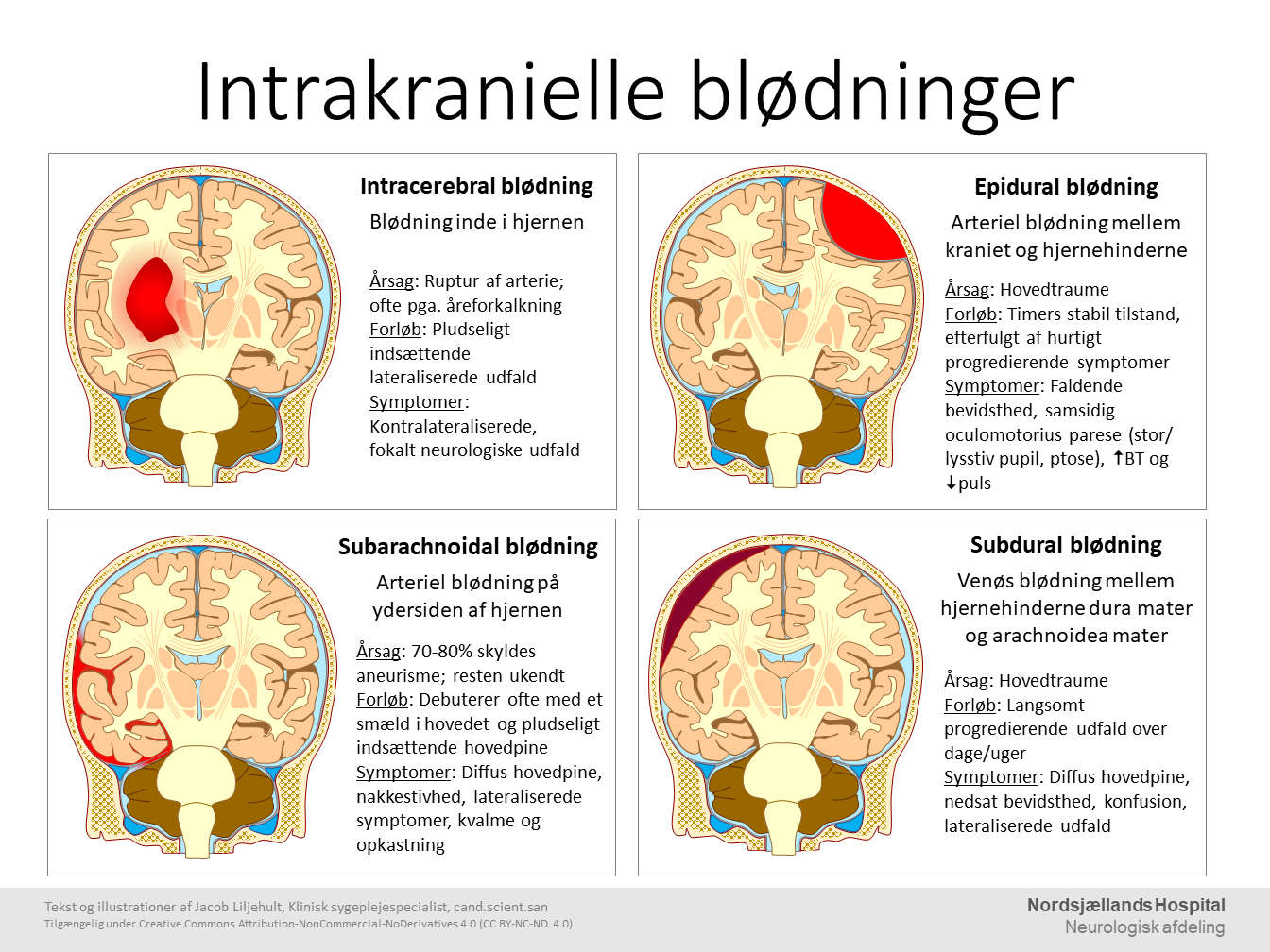
Intracerebral hæmorrhagi er forårsaget af en lækage af blod fra en arterie ud i hjernevævet. Blodet koagulerer når det kommer i kontakt med vævet og forhindre derved udvekslingen af ilt og sukker fra blodet til cellerne, hvilket gør at cellerne inde i blødningen dør. Den primære årsag til spontane intracerebrale blødninger i hjernen er patologiske forandringer i karvæggen i arterier og arterioler, fx arterosklerose på baggrund af hypertension. Andre årsager til forandringer i karvæggen kan være lipohyalinose, Charcot-Bouchard aneurismer og cerebral amyloid angiopati (Aronowski et al 2016).
Referencer
- Aronowski J, Wagner KR, Xi G, et al. Mechanisms of Cerebral Hemorrhage. In: Grotta JC (ed) Stroke - Pathophysiology, Diagnosis, and Management. New York: Elsevier, 2016, pp. 102–112.
- Dansk selskab for apopleksi. Referenceprogram for behandling af patienter med apopleksi. 3. udg. København: Dansk selskab for apopleksi; 2013.
- Easton JD, Saver JL, Albers GW, et al. Definition and evaluation of transient ischemic attack: a scientific statement for healthcare professionals from the American Heart Association/American Stroke Association Stroke Council; Council on Cardiovascular Surgery and Anesthesia; Council on Cardio. Stroke 2009; 40: 2276–93.
- Greer DM, Homma S & Furie KL. Cardiac diseases. In: Grotta JC (ed) Stroke - Pathophysiology, Diagnosis, and Management. New York: Elsevier, 2016, pp. 563–575.
- Hossmann K-A & Traystman RJ. Cerebral blood flow and the ischemic penumbra. Handb Clin Neurol 2009; 92: 67–92.
- World Health Organization. Cerebrovascular disorders : a clinical and research classification, https://apps.who.int/iris/handle/10665/37194 (1978).